C. I. Vénica; C. V. Bergamini; M. L. Capra;
A. Binetti; M. C. Perotti
Instituto de Lactología Industrial (INLAIN) –
Universidad Nacional del Litoral –
Consejo Nacional de Investigaciones
Científicas y Técnicas (UNL-CONICET) –
Facultad de Ingeniería Química (FIQ-UNL).
Santa Fe, Argentina.
[email protected]

INTRODUCCIÓN
Las leches fermentadas, dentro de las cuales se incluye el yogur, se perciben como alimentos «saludables» (Ozen y col., 2012; www.ocla.gov.ar). De las diferentes variedades que se encuentran en el mercado, el yogur rico en proteínas ha ganado gran interés del consumidor en los últimos años, en parte impulsado por mejoras en sabor y textura (productos más espesos y cremosos), y también por una mayor evidencia científica que alega beneficios a la salud de las proteínas lácteas. A este tipo de productos se lo propone para las dietas restringidas en calorías, ya que la ingesta energética de proteínas parece tener un mayor efecto sobre la saciedad que la ingesta de grasas o carbohidratos (Benelam, 2009; Pasiakos, 2015). Este hecho es de suma importancia la hora de desarrollar alimentos que contribuyan a paliar la epidemia mundial de obesidad (globesidad) que es una de las enfermedades crónicas no transmisibles (ECNT) que más se ha incrementado a nivel mundial y también en la Argentina (https://www.argentina.gob.ar/salud/alimentacion-saludable/obesidad).

Diferentes estrategias se pueden emplear para lograr este objetivo, las cuales pueden influir en la composición, actividad metabólica del starter y cinética de fermentación, e impactar en la estructura, reología y propiedades sensoriales del producto (Jørgensen y col.,2019).
Una de las opciones para lograr altos niveles de proteínas y sólidos es la adición de proteínas lácteas en polvo (leche, concentrados o aislados de proteína de suero, caseinatos, etc.) (Damin y col.,2009). Si bien una mejora en la viscosidad del yogur se le atribuyen a las proteínas de suero, también se señala la aparición de arenosidad, astringencia o amargor y acidez excesiva (Lee y Lucey, 2010;Jørgensen y col., 2019).
El objetivo de este estudio fue investigar el efecto de distintos ingredientes lácteos proteicos, empleando diferentes fermentos, en los parámetros fisicoquímicos (composición global, acidez, capacidad de retención de agua, perfiles de carbohidratos y ácidos orgánicos) y microbiológicos durante la fermentación y almacenamiento del yogur.
MATERIALES Y MÉTODOS
Se elaboraron yogures tipo batido (500 mL) siguiendo el protocolo optimizado en Vénica y col. (2013). Se prepararon seis bases lácteas mezclando leche fluida parcialmente descremada y leche en polvo escremada (LPD), y se agregaron individualmente otros ingredientes: LPD (B1), concentrados de proteínas de suero (WPC40 y WPC80, B2 y B5, respectivamente), hidrolizado de proteínas de suero (B3), aislado de proteínas de suero (B4) y suero en polvo desmineralizado (B6).
Cuatro fermentos fueron empleados individualmente, YF-L811 (F1), SLB951 (F2), Yo Flex Harmony 1.0 (F3) y Yo Flex Mild 1.0 (F4). La fermentación finalizó cuando el pH alcanzó un valor de 4,75 ± 0,05. Los productos se almacenaron a 5 ºC durante 21 días (Figura 1).
Se analizó la evolución de la acidez y de los recuentos microbiológicos durante la fermentación y almacenamiento por métodos normalizados; la composición global, los perfiles de carbohidratos y ácidos orgánicos por HPLC-IR-UV (Vénica y col. 2015) y la capacidad de retención de agua (CRA) (Akalin y col. 2012), a los 21 días.
Los datos se procesaron mediante ANOVA de una vía para cada fermento empleado, en vistas a detectar diferencias entre las diferentes bases utilizadas, y se compararon las medias con test de
Tukey. Se aplicó un análisis multivariado de componentes principales (PCA) para visualizar similitudes o diferencias entre las muestras.
RESULTADOS Y DISCUSIÓN
El pH target (4,7 – 4,8) se consiguió entre los 240 y 360 minutos. La evolución de pH fue similar para los fermentos F1, F3 y F4; el pH final se consiguió entre 240 y 270 min para las bases B2, B4 y B5, entre 260 y 300 para B3 y valores intermedios se obtuvieron para B1 y B6. Esta tendencia se acentuó aún más para el fermento F2, teniéndose el pH final para B3 a los 360 min. Jørgensen y col. (2019) también observaron variaciones en el tiempo de fermentación en yogures con alto contenido de proteínas atribuidas a la diferente capacidad buffer de los ingredientes.
El contenido de grasa de los yogures fue de aprox. 1,5 g/100 g y el de sólidos totales estuvo en el rango de 14,23 y 15,52 g/100 g. Los niveles de proteínas fueron variables, desde 4,13 g/100 g (B6) hasta 5,54 g/100 g (B3 y B4) y valores intermedios se tuvieron para las demás bases.

Los cuatro fermentos se desarrollaron adecuadamente (recuentos totales > 109 ufc/mL) para las seis bases ensayadas, y los niveles se mantuvieron hasta los 21 días. Particularmente, para Lb. bulgaricus, los
recuentos iniciales se mantuvieron o aumentaron entre 1,0 y 2,6 órdenes logarítmicos hacia el final de la fermentación; una excepción se observó para la base B3 y el fermento F2 ya que se alcanzaron mayores niveles (4,2 órdenes logarítmicos), probablemente asociado al mayor tiempo de fermentación. No se detectaron hongos y levaduras.
La acidez titulable (AT) y CRA al final del almacenamiento se visualizan en las Figuras 2 y 3, respectivamente. Similares tendencias se detectaron para los cuatro fermentos estudiados. Los valores de pH fueron similares para todos los yogures (4,35-4,58) y los niveles de AT variaron entre 100 y 134 °D, los mayores niveles se registraron para la base B3. La post-acidificación fue muy baja para todos los yogures (entre
0,15-0,30 unidades). Las bases B4 y B5 fueron las que presentaron mayor capacidad de retener agua, seguida por B2.
Mayores niveles de lactosa se detectaron en los yogures elaborados con la base B6 (5,12-5,43 g/100 g), valores intermedios (4,19- 4,83 g/100g) para aquéllos en los que se usaron las bases B1 y B2 y los niveles
más bajos para los yogures preparados a partir de B4 (3,48-4,12 g/100 g); las diferencias en los contenidos de lactosa entre los yogures a los 21 días siguieron una tendencia similar a lo observado para las muestras de leche base (datos no mostrados).
Mayores niveles de glucosa se observaron sólo para la base B3 y los fermentos F2 y F3 (0,45 y 0,55 g/100 g, respectivamente), y no se detectaron diferencias en los contenidos de galactosa (aprox. 1 g/100 g).
En cuanto a los ácidos orgánicos, el láctico es el principal compuesto generado por el metabolismo de las bacterias lácticas, mientras que los ácidos cítrico, orótico e hipúrico se encuentran naturalmente en la leche y están presentes en los ingredientes utilizados. Los valores de ácido láctico sólo se diferenciaron para el fermento F2: mayores niveles para la base B1 (1290 mg/100 g) y menores para B6 (1080 mg/100 g).
El cítrico fue el que presentó las mayores variaciones; en general, las bases B3 y B6 tuvieron los mayores niveles (valor medio 320 mg/100 g) y las bases B4 y B5 los menores (valor medio 240 mg/100 g). Una tendencia similar fue encontrada en las leches base (datos no mostrados). Las concentraciones de los ácidos orótico e hipúrico fueron muy bajas (7,74-9,20 y 0,28-3,15 mg/100 g, respectivamente); mayores niveles de orótico se detectaron en B1 para F2 y F4 y de hipúrico en B1 para F1 y en B6 para F2.
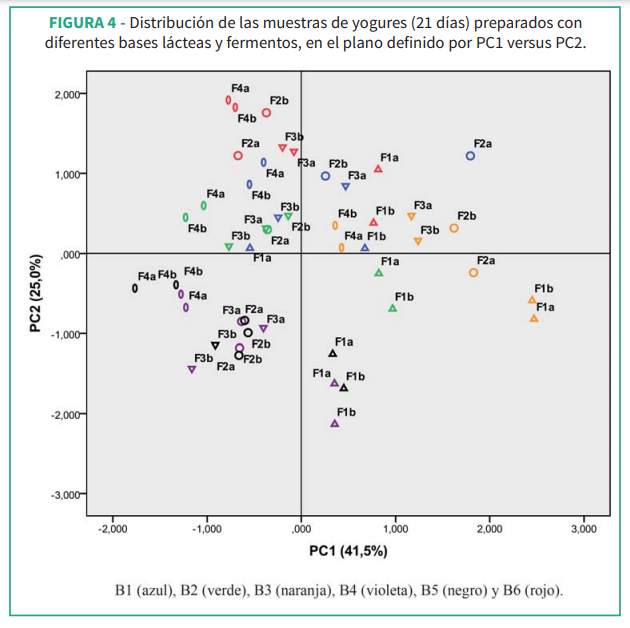
El análisis PCA es un método multivariado muy empleado para explorar la estructura de los datos, analizando interrelaciones entre un gran número de variables y detectar similitudes o diferencias entre muestras. El PCA se aplicó a la matriz constituida por pH, AT, CRA y los perfiles de carbohidratos y ácidos orgánicos analizados en todas las muestras. Los cuatro primeros componentes principales o PC representaron el 87% de la variabilidad total (41,5% en PC1, 25,0% PC2, 12,9% en PC3 y 8,2% en PC4). Glucosa, galactosa, AT y cítrico contribuyeron en el PC1 positivo y ácido hipúrico y CRA en el sentido negativo. En el PC2 positivo se ubicaron lactosa y orótico y en el sentido negativo se localizó CRA. En PC3 contribuyeron pH y AT y en PC4 el ácido láctico.
 Para simplificar la presentación de los resultados, en la Figura 4 se observa la localización de las muestras en el plano definido por PC1 vs. PC2. Las muestras B4 y B5 localizadas en el cuadrante inferior izquierdo, se caracterizaron por altos niveles de CRA e hipúrico; en el extremo opuesto se ubicaron las muestras B3 y B6 caracterizadas por mayores niveles de glucosa, galactosa, cítrico y AT. Las muestras B6 se caracterizaron por niveles elevados de lactosa y orótico contrariamente a lo encontrado para B4, B5 y B1. B3 se distinguió del resto en el plano definido por PC2 vs. PC3 con valores de AT más elevados y en el plano PC3 vs. PC4 por elevados niveles de ácido láctico (figuras no mostradas).
Para simplificar la presentación de los resultados, en la Figura 4 se observa la localización de las muestras en el plano definido por PC1 vs. PC2. Las muestras B4 y B5 localizadas en el cuadrante inferior izquierdo, se caracterizaron por altos niveles de CRA e hipúrico; en el extremo opuesto se ubicaron las muestras B3 y B6 caracterizadas por mayores niveles de glucosa, galactosa, cítrico y AT. Las muestras B6 se caracterizaron por niveles elevados de lactosa y orótico contrariamente a lo encontrado para B4, B5 y B1. B3 se distinguió del resto en el plano definido por PC2 vs. PC3 con valores de AT más elevados y en el plano PC3 vs. PC4 por elevados niveles de ácido láctico (figuras no mostradas).
Los fermentos que más se diferenciaron fueron F1 y F4 a lo largo de PC2 y PC3, ubicándose en una zona intermedia F2 y F3; se observó una tendencia creciente en los niveles de lactosa y decreciente en los niveles de glucosa y galactosa desde F1 a F4 (figuras no mostradas).
CONCLUSIONES
Los resultados ponen de manifiesto que la formulación de la leche base para yogur (particularmente en lo que respecta al tipo de ingrediente fuente de proteínas y el nivel de agregado) y el fermento empleado impactan de diferente manera en el proceso fermentativo y por lo tanto en las propiedades fisicoquímicas del producto. De las tres bases con mayor nivel proteico B3, B4 y B5, la base B5 y los fermentos F1 y F2 fueron los que presentaron las mejores características.
AGRADECIMIENTOS
El trabajo fue financiado con el proyecto PUE 2016 N° 0023 (CONICET). Los autores agradecen a las empresas Milkaut S. A., Arla Food Ingredients, Tregar S. A., Chr. Hansen y Diagrama S. A. quienes suministraron las materias primas y fermentos.
REFERENCIAS
Akalin, A.S., Unal, G., Dinkci, N., Hayaloglu, A.A. (2012). Microstructural, textural, and sensory characteristics of probiotic yogurts fortified with sodium calcium caseinate or whey protein concentrate. Journal of Dairy Science, 95(7),3617-3628.
Benelam, B. (2009). Satiation, satiety and their effects on eating behaviour. Nutrition Bulletin, 34, 126-173.
Damin, M.R., Alcantara, M.R., Nunes, A.P., Oliveira, M.N. (2009).
Effects of milk supplementation with skim milk powder, whey protein concentrate and sodium caseinate on acidification kinetics, rheological properties and structure of nonfat stirred yogurt. LWT – Food Science and Technology, 42, 1744-1750.
Jørgensen, C., Abrahamsen, R., Rukke, E., Hoffmann, T.,
Johansen, A., Skeie, S. (2019). Processing of high-protein yoghurt – A review. International Dairy Journal, 88, 42-59.
Lee, W. J., Lucey, J.A. (2010). Formation and physical properties of yogurt. Asian-Australasian Journal of Animal Sciences,
23(9), 1127-1136.
Ozen, A.E., Pons, A., Tur, J.A., 2012. Worldwide consumption of functional foods: A systematic review. Nutrition Reviews, 70 (8), 472-481.
Pasiakos, S. M. (2015). Metabolic advantages of higher protein diets and benefits of dairy foods on weight management, glycemic regulation, and bone. Journal of Food Science, 80,
A2-A7.
Vénica, C., Bergamini, C., Rebechi, S., Perotti, M. (2015).
Galacto-oligosaccharides formation during manufacture of different varieties of yogurt. Stability through storage. LWT -Food Science and Technology, 63,198-205.
Vénica, C., Bergamini, C., Zalazar, C., Perotti, M. (2013). Effect of lactose hydrolysis during manufacture and storage of drinkable yogurt. Journal of Food and Nutritional Disorders, 2(5),1-





















































